2023年8月7日,云南大学生命科学中心陈庆锋课题组联合北京大学和天津大学的团队在国际著名学术期刊Nature Chemical Biology在线发表了题为 “Structure and mechanism of a neuropeptide-activated channel in the ENaC/DEG superfamily”的研究论文(doi: 10.1038/s41589-023-01401-7),报道了一种神经肽激活的离子通道在apo状态和神经肽FMRFamide结合状态下的高分辨冷冻电镜结构,为揭示其配体特异识别的分子机制和可能的门控机制提供了科学依据。

神经肽广泛分布于无脊椎动物和脊椎动物体内。研究表明,绝大多数神经肽都是作用于G蛋白偶联受体(GPCR),从而作为神经递质或神经调节剂调控许多生物学过程。Phe-Met-Arg-Phe-amide(FMRFamide)是最先在软体动物中发现的神经肽,具有增强软体动物心肌收缩力和调节心脏跳动等功能。与多数其他神经肽不同,FMRFamide可以直接结合并激活一类隶属于ENaC/DEG超家族的钠离子通道FaNaCs(FMRFamide activated sodium channel)。尽管已经有不少研究对FaNaCs的底物结合位点进行了探究,但精确的底物结合方式和门控机制仍不清楚,有待通过结构生物学等手段阐明。
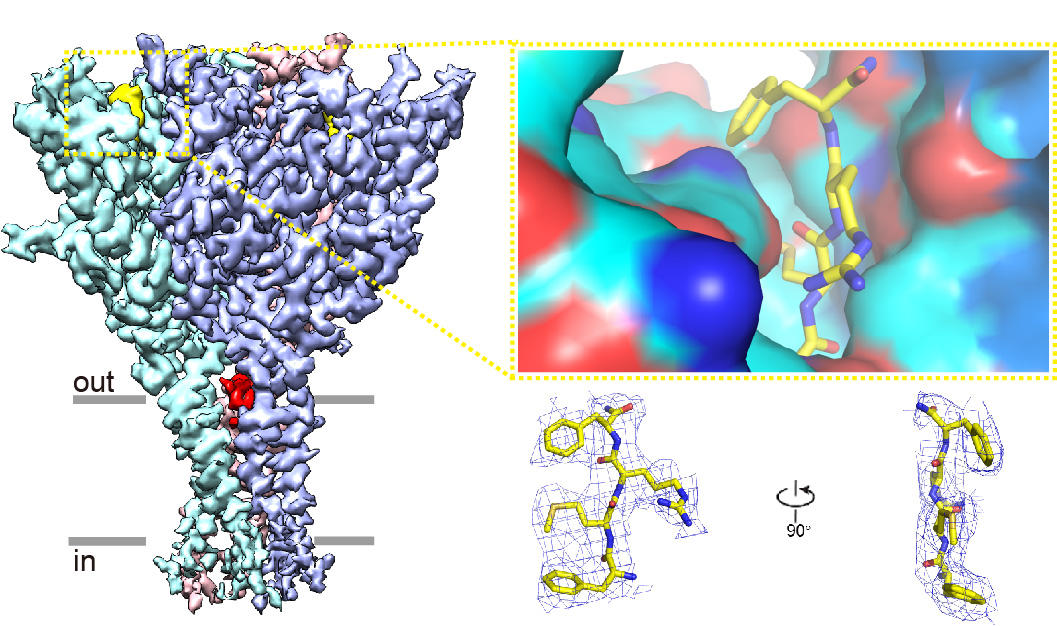
该研究解析了海兔FaNaC(Aplysia californica FaNaC,下称AcFaNaC)在apo状态和FMRFamide结合状态下的高分辨率冷冻电镜结构。AcFaNaC形成杯状的同源三聚体,单体则形似握紧的拳头,可分为拇指、手指、指关节、手掌等结构域。FMRFamide以N端插入的方式紧密结合在AcFaNaC每个亚基胞外结构域(ECD)最上方的一个口袋里,该口袋主要由手指结构域、β6和β7之间的loop(β6–β7-loop),以及相邻亚基指关节结构域的部分残基(Ala486和Phe453)构成,在顶部和一侧各有1个开口。在结合的FMRFamide分子中,各个残基的侧链大致分布在一个平面上。以主链所在的直线为参照,疏水残基Phe1、Met2和Phe4的侧链指向一侧(疏水侧),而亲水残基Arg3的侧链则指向相反方向(亲水侧)。FMRFamide的主链与β6–β7-loop的主链走向相反,通过大量的氢键相互作用,形成反向平行的β片层;FMRFamide的疏水侧与大量的疏水氨基酸相互作用,其中Met2和Phe453之间的互作最为关键,亲水侧则通过疏水作用和氢键共同稳定;C末端的酰胺基团与相邻亚基指关节结构域的Ala486的羰基氧形成氢键。FMRFamide的结合引起结合口袋的坍塌,并使单体发生顺时针旋转。该研究发现,在apo状态下,指关节结构域的Phe474与Lys264形成cation-pi键,而在FMRFamide结合态中该互作被破坏,这可能是整个构象变化的起始和传递所必需的。上述构象变化通过手掌结构域向跨膜结构域(TMD)传递(其中ECD-TMD交界处的Tyr329和Phe120尤为关键),导致跨膜螺旋外移、离子传导孔扩张和钠离子的跨膜流通。总之,该研究通过结合结构生物学、定点诱变、电生理学和分子动力学模拟等手段,大大提高了我们对FaNaCs乃至整个ENaC/DEG超家族离子通道的结构、功能和进化等方面的认识。
云南大学生命科学学院博士研究生刘凤莲、北京大学生命科学学院博士研究生党瑜、天津大学医工院博士研究生李璐和天津大学生命科学学院硕士研究生冯浩为该论文的共同第一作者。陈庆锋教授、田裕涛教授、叶升教授和张哲教授为共同通讯作者。该研究工作得到了科技部重点研发计划、国家自然科学基金面上项目、天津市杰出青年科学基金的资助。
供稿:生命科学学院
编辑:李哲
责任编辑:王崴