药学院肖伟烈团队长期开展计算机辅助的活性天然产物研究,包括抗炎天然产物数据库构建和化学信息学研究,活性靶标发现等。近年来,团队与软件学院李劲课题组开展跨学科合作,在基于深度学习的天然产物活性-靶标预测方法开发方面取得了一系列研究进展,为活性天然产物的高效发现提供了有力的工具,并运用这些方法发现了多个靶标明确的活性苗头分子。
天然产物是活性先导分子的重要来源,近20年来,全世界研发出的药物小分子新化学实体中,约有65%可追溯到天然产物。然而很多天然产物分离量较少,无法满足大规模的活性筛选,极大地限制了天然产物的深入研究。基于人工智能(AI)的药物发现为新靶标发现和精准药物设计带来了新的可能性。深度学习是AI中的一类方法,具有自动提取数据特征的能力,不需要依赖人工归纳总结数据特征,能够发现数据之间的隐性关联。
进展一:首个天然产物抗炎活性分类和靶标预测模型(图1)。研发针对新型抗炎机理和疾病特异性靶标的抗炎药物是目前的迫切需求,但针对抗炎天然产物研究,还缺乏相应的数据库和活性预测方法。团队在原创数据库的基础上,设计了一种新的深度学习分子表示方法multi-tokenization transformer model,并以此为基础建立了首个天然产物抗炎活性分类和靶标预测模型。数据库和预测模型集成在抗炎天然产物研究的综合在线平台InflamNat(http://www.inflamnat.com/),为药物化学、药理学、化学/生物信息学等学科的研究者提供支持。该工作已发表在化学信息学权威期刊Journal of Cheminformatics (文章1,J. Cheminform. 2022 Jun 4;14(1):30. doi: 10.1186/s13321-022-00608-5)。
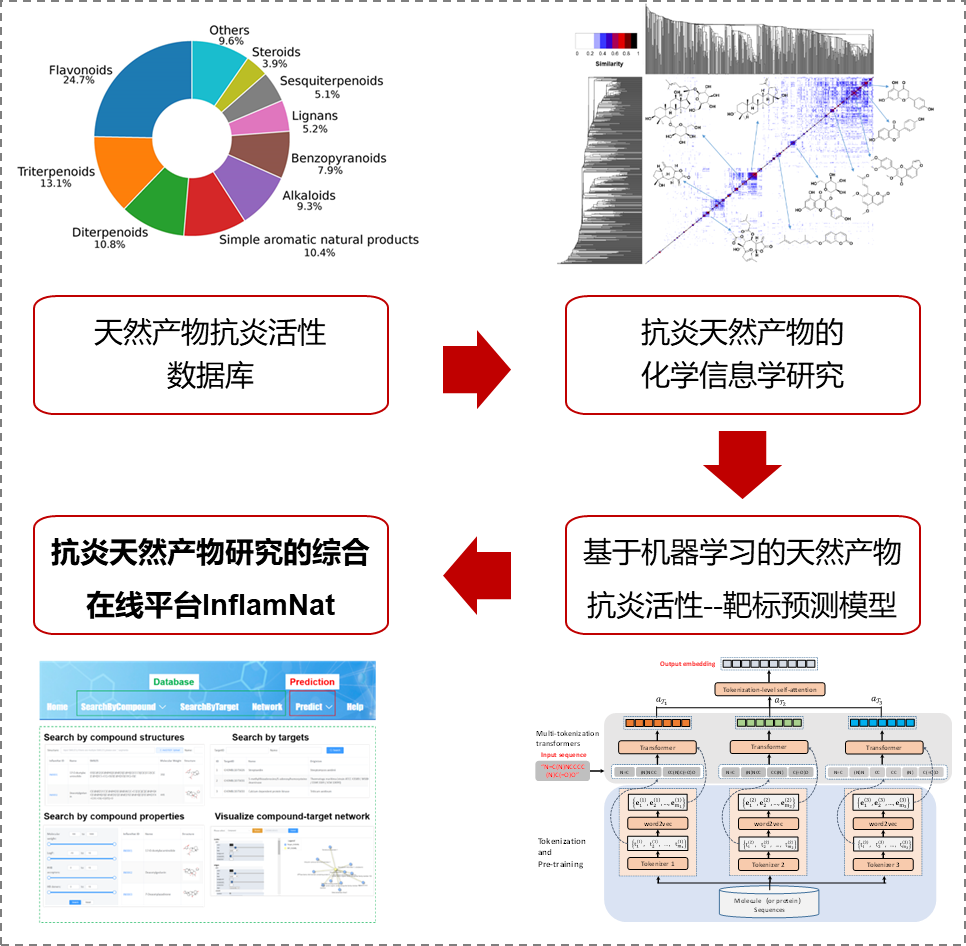
图1 基于人工智能的天然产物抗炎活性-靶标预测系统(文章1)
进展二:基于深度学习的表观遗传调控活性分子预测方法。表观遗传调控作为一种靶向临床治疗策略,是目前药物研究的热点之一。然而,多靶点效应造成的毒性和耐药问题,极大地限制了表观遗传药物的临床应用。此外,除少数最受关注的靶标外,大多数表观遗传靶标的活性分子报道较少、活性较低、选择性不佳。针对表观遗传靶标的先导化合物发现和药物研究还有很大的探索空间。为解决样本稀缺和多靶标活性预测问题,团队采用元学习和多任务学习方法,分别构建了面向小样本组蛋白修饰酶抑制剂预测方法MetaHMEI和表观遗传调控分子预测方法MT-EpiPred。多任务学习预测模型MT-EpiPred开发为免费访问的网络服务器(http://epipred.com),用户只需要输入化合物的SMILES,就可以获得包含多个小样本靶标在内的78个表观遗传靶标的预测打分以及靶标信息的页面链接,从而更有针对性地进行活性研究。运用上述方法,针对活性分子稀缺的组蛋白去甲基化酶JMJD3、KDM4D等靶标,发现了多个具有发展潜力的天然先导骨架。以上工作分别发表于生物信息学顶级期刊Briefings in Bioinformatics (文章2, Brief. Bioinform. 2023, 24 (3). DOI: 10.1093/bib/bbad115.)和药物设计学权威期刊Journal of Chemical Information and Modeling (文章3, J. Chem. Inf. Model. 2023 online. DOI: 10.1021/acs.jcim.3c01368)。
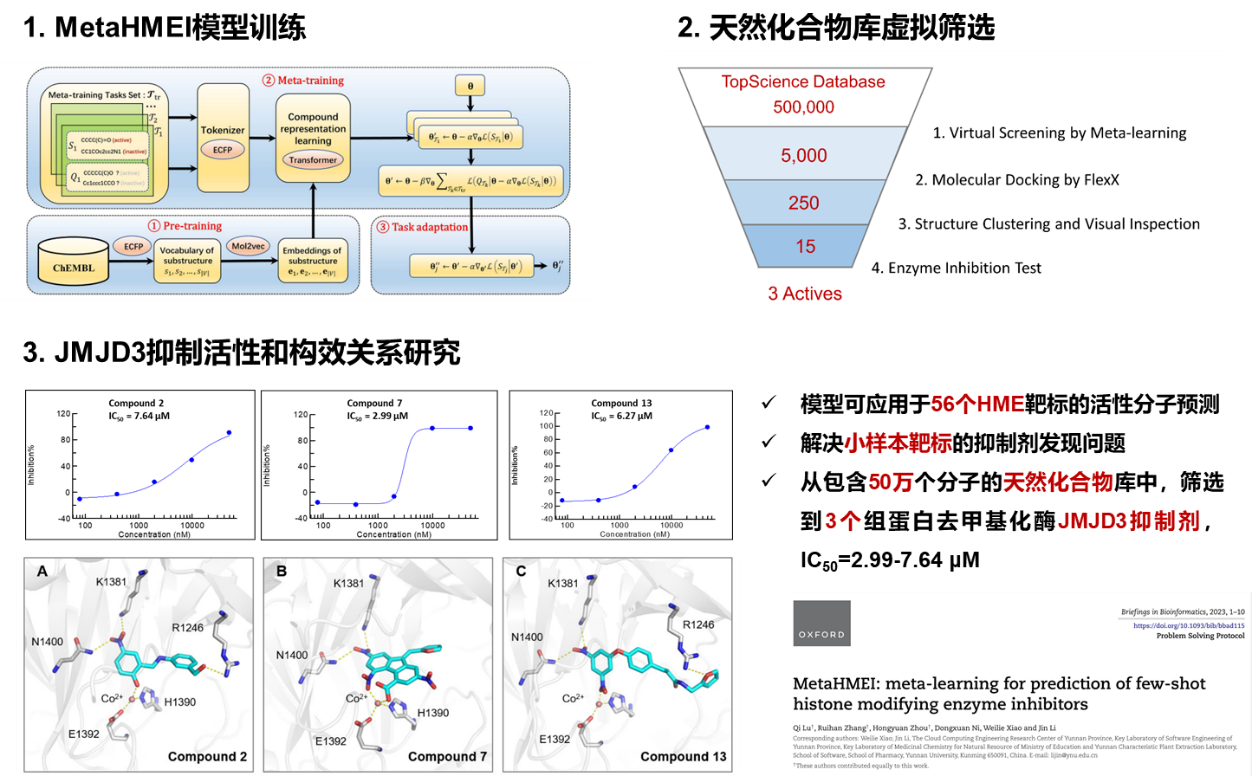
图2 基于元学习的组蛋白修饰酶抑制剂预测方法MetaHMEI(文章2)
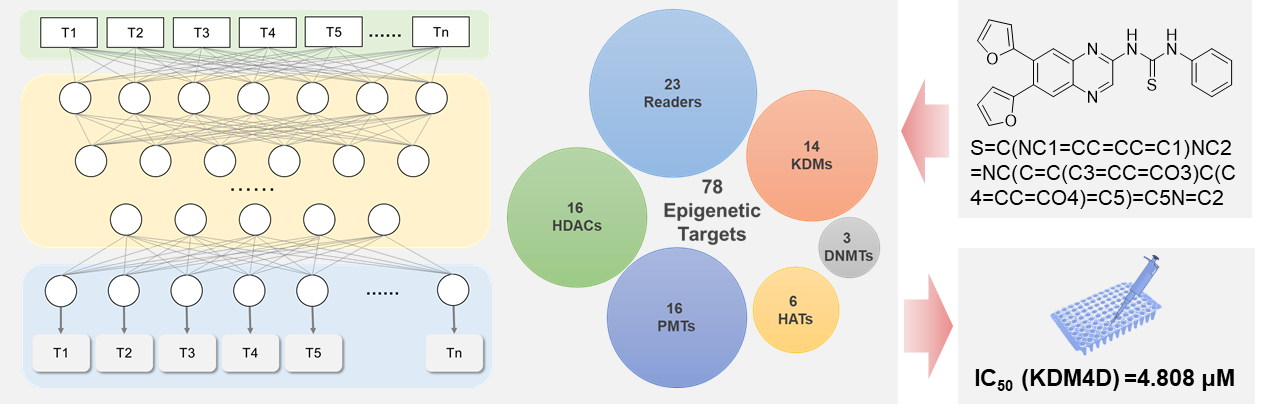
图3 基于多任务学习的表观遗传调控分子预测方法MT-EpiPred(文章3)
药学院张芮菡副研究员为文章1、3的第一作者和文章2的共同一作,软件学院硕士研究生鹿琦、任首朋、谢星燃分别为文章2的第一作者和文章1、3的共同一作,药学院硕士研究生周宏元、博士研究生倪冬暄分别为文章2、3的共同一作。药学院肖伟烈研究员和软件学院李劲教授为3篇文章的共同通讯作者。以上工作得到了云南大学“双一流”建设项目、国家自然科学基金、云南省优秀青年项目、云南省应用基础研究重点项目、“兴滇英才支持计划”云岭学者和青年人才专项、云南省特色植物筛选与研发服务CXO平台项目的资助。
供稿:药学院
编辑:李哲 责任编辑:王崴