2024年4月24日,药学院高峰/实验动物中心任晓霞以共同通讯作者在Angew. Chem. Int. Ed.上在线发表研究论文“Bithiophene-Functionalized Infrared Two-Photon Absorption Metal Complexes as Single-Molecule Platforms for Synergistic Photodynamic, Photothermal, and Chemotherapy”,构建了一种诊疗一体化的单分子金属配合物,用于光动力/光热/化疗多模式协同抗肿瘤治疗。
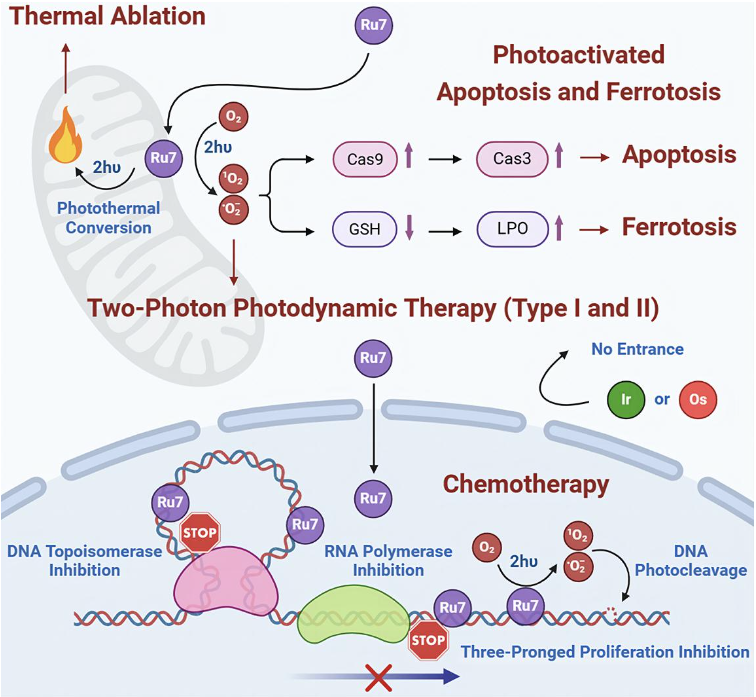
光治疗采用不同于化疗的分子机制,可能成为解决化疗药物长期使用中所产生的耐药性的捷径。光动力治疗在面对缺氧环境的实体肿瘤时的效果受到明显限制。结合光热机制能够一定程度上提升氧的供给,同时借助热疗机制协同破坏肿瘤细胞。通常这样的协同作用需要借助多组分多功能的固体纳米颗粒,存在着制备上难以尺寸均一化、体内安全性等方面的担忧。
在本研究中,研究组通过将具有多种活性的双噻吩基团引入经典的DNA嵌合配体,构建了其钌、锇、铱三种金属的、多种辅助配体的十三个配合物,筛选出具有多种优势的钌配合物Ru7。Ru7具有优异的双光子吸收性质、良好的亲脂性、同时具有一型和二型光动力治疗机制、温和的光热治疗能力,以及较强的化疗活性。Ru7在细胞内同时分布于线粒体和细胞核,使其同时在线粒体发挥活性氧相关光治疗机制和在细胞核内发挥DNA相关化疗机制成为可能。Ru7以插入模式结合DNA,阻断DNA拓扑异构酶和RNA聚合酶这两种肿瘤细胞内高表达的重要化疗靶点的功能,并在单、双光子激发下进行DNA光断裂作用,使肿瘤细胞的增殖受到三重机制的抑制。Ru7在双光子激发下还能诱导肿细胞凋亡、铁死亡等,表现出丰富的抗肿瘤机制。在体内,Ru7显著抑制了恶性黑色素瘤和非小细胞肺癌耐药瘤的生长,在50%的小鼠体内实现了肿瘤的完全消融,表现为高治疗效果。Ru7对正常肝、肾细胞具有极微弱的毒性,小鼠存活率100%,并且治疗结束后,Ru7能够从体内有效清除,表现为高安全性。同时Ru7具有优异的荧光成像和光热成像性质,为肿瘤诊断和辅助治疗成像方面的应用提供了支持。这一工作将为多模式协同抗肿瘤诊疗一体化平台的构建提供一种新的思路。
该工作历时近五年,药学院/自然资源药物化学教育部重点实验室硕士研究生(18级至23级排列)李国奎、王梦凡、赵润宇、刘复旦、李雪莲、曾利珍、闫禹霏、李韵为共同完成人。张洪彬教授在研究经费上给予了大力支持,项目得到了国家自然科学基金地区基金、云南省基础研究计划面上项目和重点项目、云南省领军人才和青年拔尖人才项目的支持。化学科学与工程学院丁军桥、李灿鹏、周莹,生物医药研究院张贝贝,湖泊院周起超,药学院程晓红、杜琳、夏成峰等老师也在项目进行中给予了支持和帮助。
来源:药学院
编辑:李哲 责任编辑:王崴