2023年8月25日,云南大学化学科学与工程学院联合北京大学、西南大学、山西大学等机构的团队在Science Advances(Nature Index期刊,影响因子13.6)在线发表了题为“Transformable nano-antibiotics for mechanotherapy and immune activation against drug-resistant Gram-negative bacteria”的研究论文(DOI: 10.1126/sciadv.adg9601),报道了一种基于超分子自组装技术用于超级耐药革兰氏阴性菌检测和治疗的策略(图1)。全文链接:https://www.science.org/doi/10.1126/sciadv.adg9601
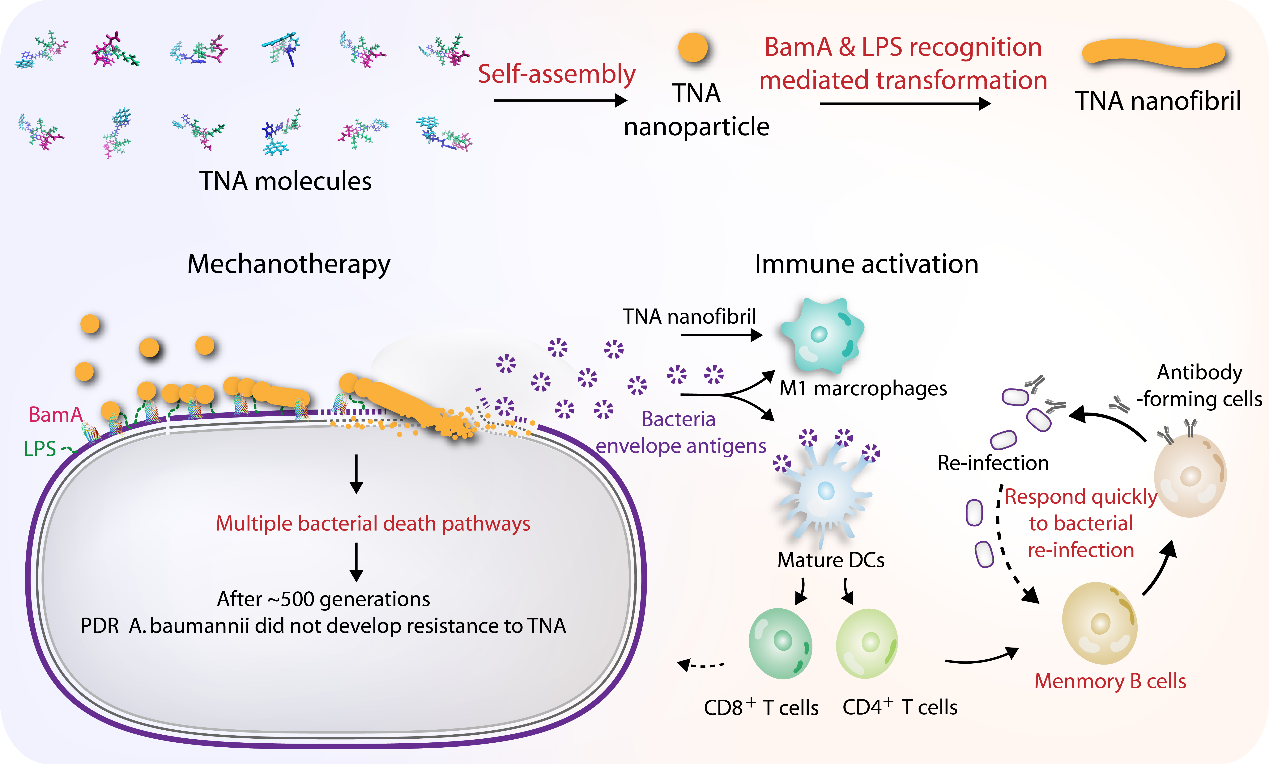
图1基于小分子多肽自组装形成的可变形纳米抗生素(TNA)用于破坏超级细菌膜结构并激活免疫响应的示意图。
在近一个世纪的抗感染治疗中,医院中大量革兰氏阴性菌长期处于抗生素环境中。目前众多革兰氏阴性菌对碳青霉烯类或第三代头孢菌素均表现出了获得性耐药性。值得警惕的是,近十年来在全球范围内革兰氏阴性菌对最后一线抗革兰氏阴性菌药物(多粘菌素)的耐药性呈逐年上升的趋势,因此迫切需要开发针对革兰氏阴性菌的新型抗生素。然而,目前针对革兰氏阴性细菌的抗生素开发极为困难,主要原因在于革兰氏阴性菌独特的外膜结构(革兰氏阳性菌无外膜)。革兰氏阴性菌以坚硬且难通透的外膜作为屏障,可阻挡大多数抗生素和抗菌肽的渗透,并且还可通过外膜伪装其抗原表位或分泌囊泡来隔离抗原呈递以抑制宿主免疫反应。因此,开发一种不仅可以破坏革兰氏阴性菌外膜,还可以促进外膜抗原呈递的策略将是一种理想的对抗耐药革兰氏阴性菌的途径。
该研究设计了一种基于小分子多肽自组装形成的可变形纳米抗生素(TNA)。TNA在无菌生理环境中可组装为松散的纳米颗粒(无可见荧光),在遇到革兰氏阴性菌后可识别革兰氏阴性菌外膜独特的脂多糖和β桶状蛋白,从而聚集于细菌外膜。聚集的颗粒状TNA在十分钟内逐渐转变为坚硬的纤维结构,并显现出强烈的青色荧光(该信号可用于革兰氏阴性菌检测)。更重要的是,外膜上原位形变形成的TNA纤维具有合适的刚性和扩散性,能有效破坏泛耐药和多粘菌素耐药的革兰氏阴性菌外膜。研究发现TNA的这种纳米机械作用会干扰细菌膜中电子传递链复合物I,同时破坏多种保守的生物合成和代谢途径。在用TNA半数抑菌浓度刺激细菌约500代后,仍未见耐药性。此外,TNA破坏细菌外膜快速释放的外膜抗原可有效激活机体先天性和适应性免疫系统,包括:巨噬细胞的M1极化、树突状细胞的成熟、CD4+和CD8+ T细胞的增殖,以及细菌感染相关记忆B细胞的获得。在小鼠模型中,TNA治疗可对浅表伤口和腹腔感染提供实质性保护并提高小鼠再次感染后的存活率。
该论文的第一作者为云南大学化学科学与工程学院李荣生副教授,通讯作者为北京大学李娜教授,西南大学黄承志教授以及山西大学石虎副教授。李荣生副教授于2022年7月通过云南大学东陆青年学者计划进入云南大学工作,已在Nano Letters、Chemical Science、Analytical Chemistry等期刊发表学术论文三十余篇,目前已获得国家自然科学基金青年项目的资助。该工作得到了国家自然科学基金、云南大学“双一流”建设人才引进基金的资助,同时也获得了北京大学分析测试中心和云南大学分析测试中心在测试方面的帮助。
供稿:化学科学与工程学院
编辑:李哲
责任编辑:王崴