溶酶体作为细胞中重要的分解代谢细胞器,既负责降解回收细胞内外的物质,又通过感知营养状态维持代谢稳态。其功能障碍与多种代谢性疾病密切相关。其中,同型半胱氨酸血症(Hyperhomocysteinemia,简称HHcy)是一种常见的代谢紊乱。血液中的同型半胱氨酸累积,常由遗传因素、营养缺乏、疾病或不良生活习惯引起,并与心血管疾病、神经退行性疾病等相关。然而,代谢中间产物的异常积累如何导致溶酶体受损,以及受损溶酶体如何推动疾病进展,仍缺乏明确机制。
2025年11月25日,云南大学生命科学学院杨崇林(现任职于首都医科大学附属北京儿童医院)与杨玫课题组在《Journal of Cell Biology》发表题为 “Homocysteine disrupts lysosomal function by V-ATPase inhibition”的研究论文。研究团队利用秀丽隐杆线虫(C. elegans)进行非偏好性的遗传筛选,首次揭示了同型半胱氨酸(Hcy, 又称高半胱氨酸)累积直接损害溶酶体功能的分子机制,并在小鼠模型中得到验证,揭示了溶酶体功能障碍在同型半胱氨酸血症中的关键致病作用。

研究人员发现,秀丽隐杆线虫的cbs-1基因缺失会导致溶酶体异常增大和功能障碍,并伴随多种未消化底物的积聚及严重的膜损伤。结合遗传学分析、代谢物分析与膳食调控实验,证实cbs-1缺失引起的同型半胱氨酸异常积累是导致线虫溶酶体功能障碍与发育缺陷的直接原因。
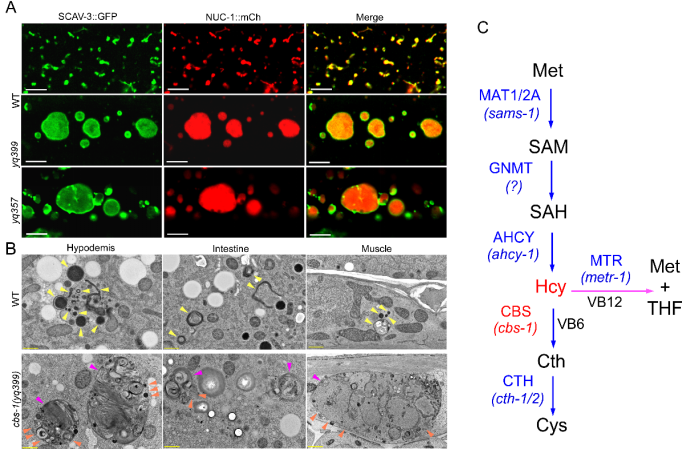
图1.(A) WT、cbs-1(yq399)和cbs-1(yq357)线虫的表皮细胞溶酶体的荧光图像。(B) WT与cbs-1突变体线虫的表皮、肠道及肌肉细胞溶酶体的电镜图像。黄色、橙色和品红色箭头分别指示正常溶酶体、膜破损溶酶体及伴有底物累积的异常增大溶酶体。(C)同型半胱氨酸代谢通路。
研究人员进一步发现,Hcy能结合并修饰溶酶体V-ATPase复合体的VHA-12与VHA-13亚基,抑制其水解ATP的活性,从而破坏溶酶体的酸化环境,呈现溶酶体贮积症的典型病理特征。
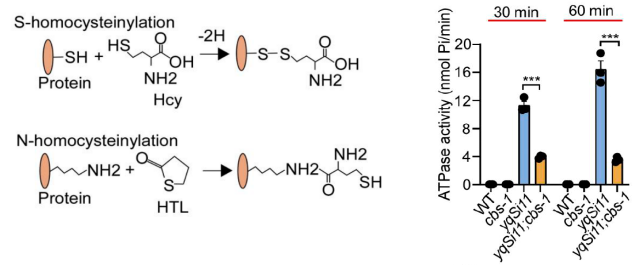
图2.同型半胱氨酸修饰示意图(左);V-ATPase活性受同型半胱氨酸修饰所抑制(右)。
最后,研究人员在Cbs 敲除小鼠模型中也观察到Hcy异常累积的表型,并在多个器官中观察到类似溶酶体贮积症的溶酶体功能障碍和结构损伤。
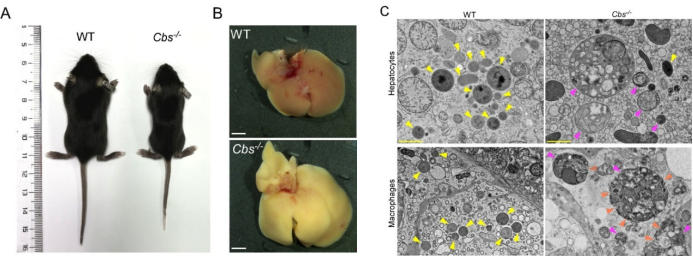
图3.(A) 14天龄WT与Cbs敲除小鼠形态对比图。(B) WT与Cbs敲除小鼠肝脏图像。(C) WT和Cbs-/-小鼠肝细胞(上)和巨噬细胞(下)的TEM图像。黄色、橙色和品红色箭头分别指示正常溶酶体、膜破损溶酶体及伴有底物累积的异常增大溶酶体。
该研究首次揭示了氨基酸代谢中间物-同型半胱氨酸损伤溶酶体的分子机制,并揭示了溶酶体功能障碍在高同型半胱氨酸血症及相关代谢性疾病中的关键致病作用,为理解这些危及生命的代谢疾病的发生和发展机制以及潜在治疗策略提供了重要启示。
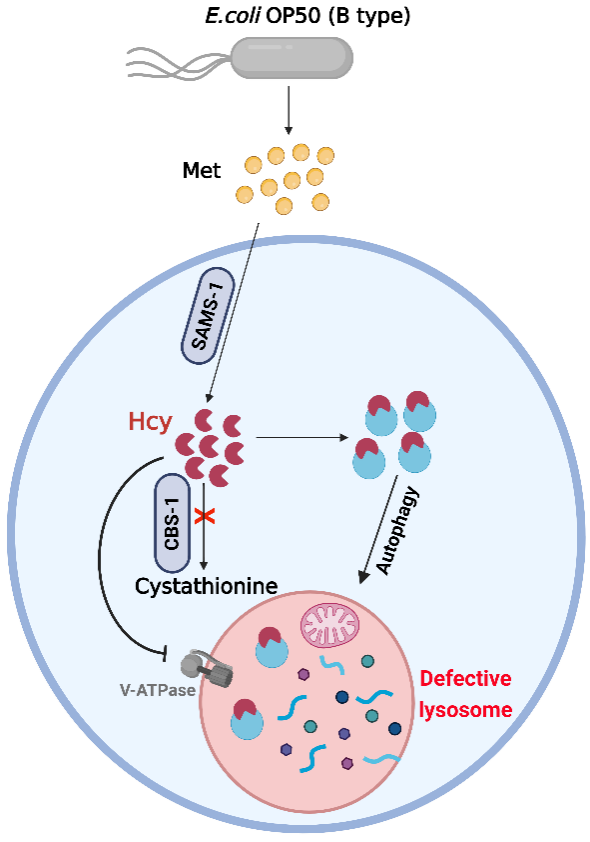
图4.Hcy通过修饰v-ATPase诱发溶酶体功能障碍模式图。(Yang et al., JCB, 2025)
云南大学生命科学学院杨崇林教授(现首都医科大学附属北京儿童医院/国家儿童医学中心)及杨玫研究员为本文通讯作者,博士研究生杨扬、孔前进和刘朝莲为共同第一作者,云南大学生命科学学院电镜平台李美娇和王鑫老师提供了电镜支持,云南大学生命科学学院李莎兰老师、Leonard Krall研究员、武旭娜研究员提供了同型半胱氨酸修饰的质谱分析帮助, 云南大学生命科学学院姜凯研究员和侍月会博士提供了蛋白质结构分析。该研究工作得到了国家重点研发计划;国家自然科学基金委重大项目和云南省科技领军人才计划的资助。
原文链接:https://doi.org/10.1083/jcb.202503081
来源:生命科学学院
编辑:张懿淼 责任编辑:李哲