
2026年1月6日,云南大学生命科学学院杨崇林/尹秋媛研究团队在Journal of Cell Biology上发表了题为“Plasma membrane-to-lysosome FGR signaling regulates endocytosis-associated lysosome homeostasis”的研究论文。
溶酶体是真核细胞内降解回收物质的关键细胞器,也是整合代谢与信号的重要枢纽。为应对环境变化,细胞通过调控溶酶体生物发生来维持稳态,该过程主要受转录因子TFEB/TFE3介导。虽然营养物质经mTORC1调控TFEB/TFE3的机制较为明确,但细胞表面信号如何跨区室传递并诱导溶酶体生成,仍是尚未解决的重要问题。
该研究通过秀丽隐杆线虫异源表达系统进行筛选,首次发现抑制SRC家族激酶src-1/src-2可诱导TFE3核转位并增强溶酶体功能。在哺乳动物细胞中,其同源蛋白为FGR,参与调节细胞表面受体信号转导,在细胞生长、分化、粘附和迁移等过程中发挥重要作用。敲除或抑制FGR能促进TFEB/TFE3入核并增加溶酶体生成。研究发现,FGR并不直接作用于TFEB/TFE3,而是通过磷酸化并激活激酶AKT2(特异性作用于其Tyr122位点),进而由AKT2磷酸化TFEB/TFE3,抑制其转录活性。
该研究揭示了一条从质膜到溶酶体再到调控细胞核转录的完整信号轴,即 FGR‑AKT2‑TFEB/TFE3通路。该通路受内吞活动动态调控:当内吞活跃、生长信号充足时,质膜定位的FGR随内吞过程转运至溶酶体,激活并招募AKT2,进而磷酸化并抑制TFEB/TFE3,从而限制溶酶体的过度生成;反之,当内吞受阻或营养匮乏时,该抑制信号被阻断,TFEB/TFE3得以活化,驱动溶酶体生物发生以增强降解与代谢回收能力。
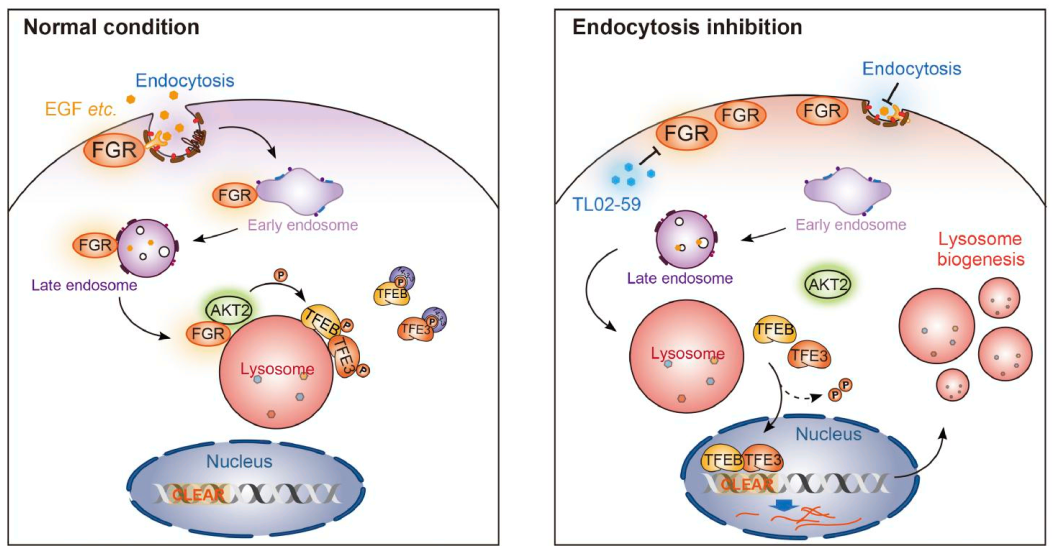
值得注意的是,FGR在包括急性髓系白血病在内的多种癌症中高表达,提示该通路的异常激活可能与肿瘤细胞代谢重组及生存适应密切相关。因此,这一机制在空间与功能上构建了“细胞外环境‑溶酶体‑细胞核”之间的适应性信号环路,并阐明了细胞如何依据外界信号与内吞状态来精确调控溶酶体数量与功能,维持代谢稳态与细胞适应性,同时,还对肿瘤及溶酶体相关疾病的治疗策略开发提供了潜在靶点与新思路。
云南大学生命科学学院杨崇林教授(现首都医科大学附属北京儿童医院/国家儿童医学中心)及尹秋媛副研究员为论文通讯作者。云南大学生命科学学院李莎兰、武旭娜研究员提供了质谱分析帮助。中国科学院昆明植物研究所郝小江院士及丁骁副研究员在研究初期为该研究提供了重要的实验材料。赖凡教授为该研究生信分析提供帮助。该研究获国家自然科学基金、云南省科技领军人才计划、云南省基础研究计划等项目支持。
文章链接:https://doi.org/10.1083/jcb.202506139
来源:生命科学学院
编辑:奚利 责任编辑:李哲