近日,云南大学云南生物资源保护与利用国家重点实验室张志刚研究员团队联合在奥贝胆酸(Obeticholic acid, OCA)治疗非酒精性脂肪肝病(NAFLD)的肠道微生物调控机制方面取得新进展。相关研究成果于2023年5月31日发表在npj Biofilms and Microbiomes(5年IF=9.667)。
NAFLD是包括单纯性脂肪肝、非酒精性脂肪性肝炎、肝纤维化和肝硬化等以脂肪在肝细胞大量堆积为特征的综合临床疾病。NAFLD是全球范围内最为流行的慢性肝病之一(成人发病率为10%—40%),并且在中国NAFLD正逐渐取代乙肝成为主要的慢性肝病。肠道微生物与人体健康息息相关,前人的研究证实了肠道微生物在NAFLD和非酒精性脂肪肝炎(NASH)中发挥重要影响(Schnabl et al., 2014; Boursier & Diehl, 2016),而短链脂肪酸、氨基酸和酒精等肠道微生物代谢物也被发现是NAFLD发病的重要因素(Chen & Vitetta, 2020; Canfora et al., 2020)。肠道微生物及其代谢物通常可以通过肠肝轴诱导肝脏的脂肪沉积和炎症的发生(Yoshimoto et al., 2016),但其具体机制仍有待进一步阐明。
肠道内胆汁酸受宿主和肠道微生物共同影响,初级胆汁酸经肝脏细胞合成后储存在胆囊胆汁中,经胆囊收缩后释放进入十二指肠,肠道微生物能编码合成胆酸水解酶(BSHs, EC 3.5.1.24)和7α-羟基类固醇脱氢酶(7α-HSDs, EC 1.1.1.159)进而对初级胆汁酸进行修饰转化,尤其是7α-HSDs可以将初级胆汁酸转化为次级胆汁酸。胆汁酸中如鹅去氧胆酸(CDCA)、脱氧胆酸(DCA)等可以激活法尼醇X受体(farnesoid X receptor, FXR),而FXR不仅可以调节胆汁酸合成和转运,还能通过诱导肝脏和胃肠道保护性细胞反应,发挥调节炎症、免疫反应和肝脏再生(Gadalet et al., 2021; Lefebvre et al., 2022)。因此,肠道微生物很可能通过介导胆汁酸代谢,影响宿主的健康状态。
OCA是CDCA的衍生物,同时也是FXR的激动剂,是美国Intercept制药公司研发的首个用于治疗胆汁淤积性肝病的药物,并且是目前唯一一个完成Ⅲ期临床用于治疗NASH的药物。在小鼠模型中,OCA能有效缓解NAFLD小鼠肝脏脂肪堆积、肝细胞炎症以及胰岛素抵抗(Cipriani et al., 2010, Adorini et al., 2012; Neuschwander-Tetri et al., 2015),结合肠道微生物对NAFLD和NASH的重要影响,团队推测,肠道微生物很可能通过微生物-胆汁酸轴在OCA治疗NAFLD中发挥重要的调节作用。因此,本研究利用高脂饮食诱导的NAFLD小鼠模型,结合宏基因组、靶向代谢组等技术手段解析了肠道微生物在OCA治疗NAFLD的重要调控作用。利用抗生素鸡尾酒和粪菌移植等方式,团队首先证实了肠道微生物的存在是OCA发挥NAFLD治疗作用的基础,在抗生素敲除肠道微生物后,OCA无法有效缓解NAFLD小鼠肝脏损伤(包括组织病理形态和肝功能指标),而移植接受OCA治疗小鼠的粪便同样能起到缓解NAFLD小鼠肝损伤的效果(图1)。通过宏基因组学和靶向代谢组学分析,团队发现相比于NAFLD小鼠,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)和多种拟杆菌(Bacteroides spp.)、另枝菌(Alistipes spp.),以及双歧杆菌(Bifidobacterium spp.)在正常小鼠和OCA治疗组小鼠肠道中富集,并且OCA显著降低了NAFLD小鼠血清中的初级胆汁酸(CA和CDCA)、多数游离胆汁酸(DCA, CDCA, UDCA)和结合胆汁酸(如TCDCA和 THDCA)。此外,相比于NAFLD组,在正常组与OCA治疗组中丰度显著变化的细菌,其丰度与差异胆汁酸含量显著相关。通过筛查细菌基因组中编码胆汁酸转化酶的基因,团队发现在正常组和OCA治疗组小鼠中大量富集的微生物具有更强的编码7α-HSDs的潜力,能够促进初级胆汁酸转化生成次级胆汁酸(图2)。
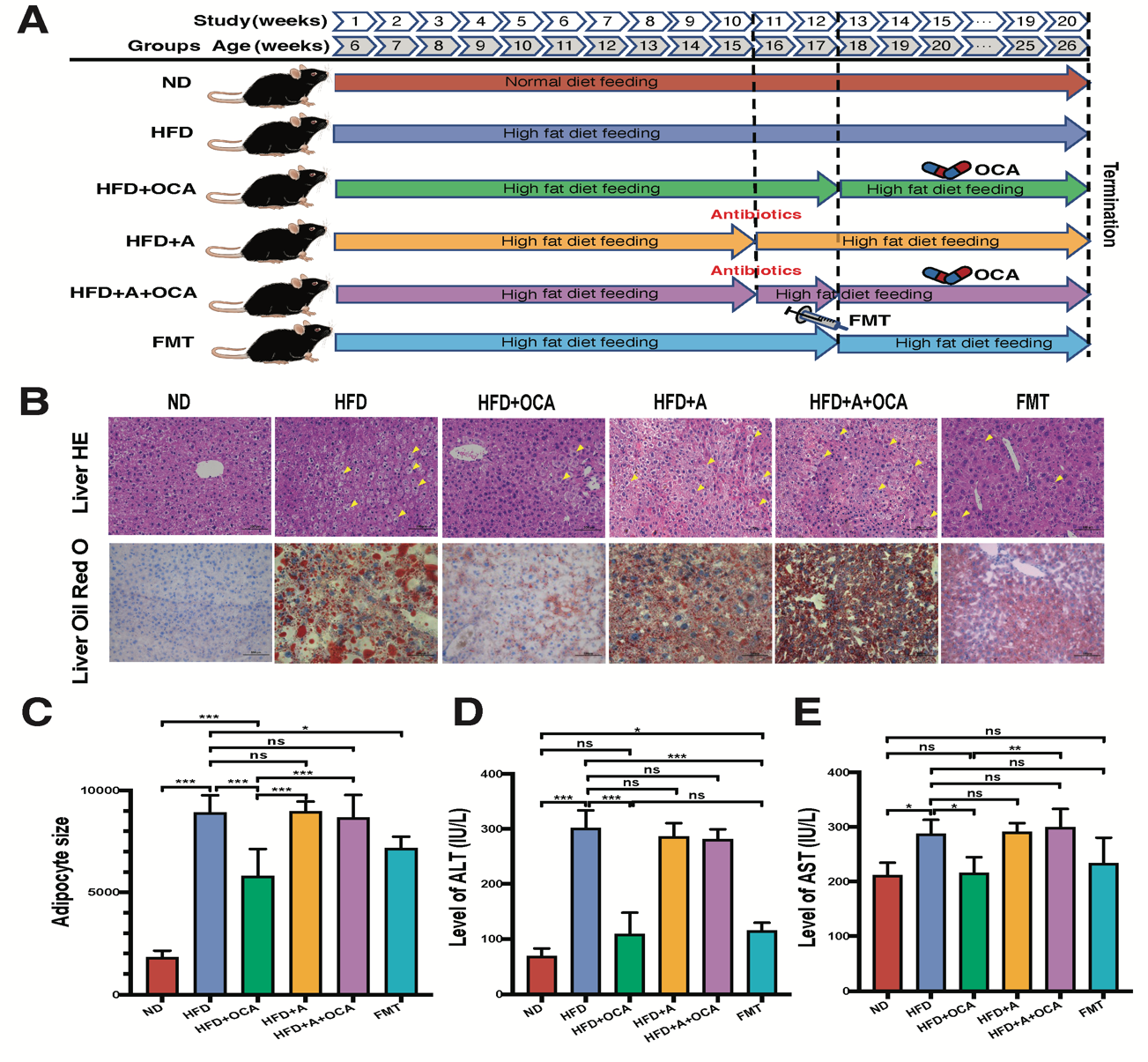
图1 试验设计及各组小鼠表型差异
(ND为正常饮食组、HFD为高脂饮食诱导的NAFLD组,HFD+OCA为OCA治疗组,HFD+A为高脂饮食+抗生素处理组, HFD+A+OCA为高脂饮食+抗生素处理+OCA处理组,FMT为粪菌移植组)
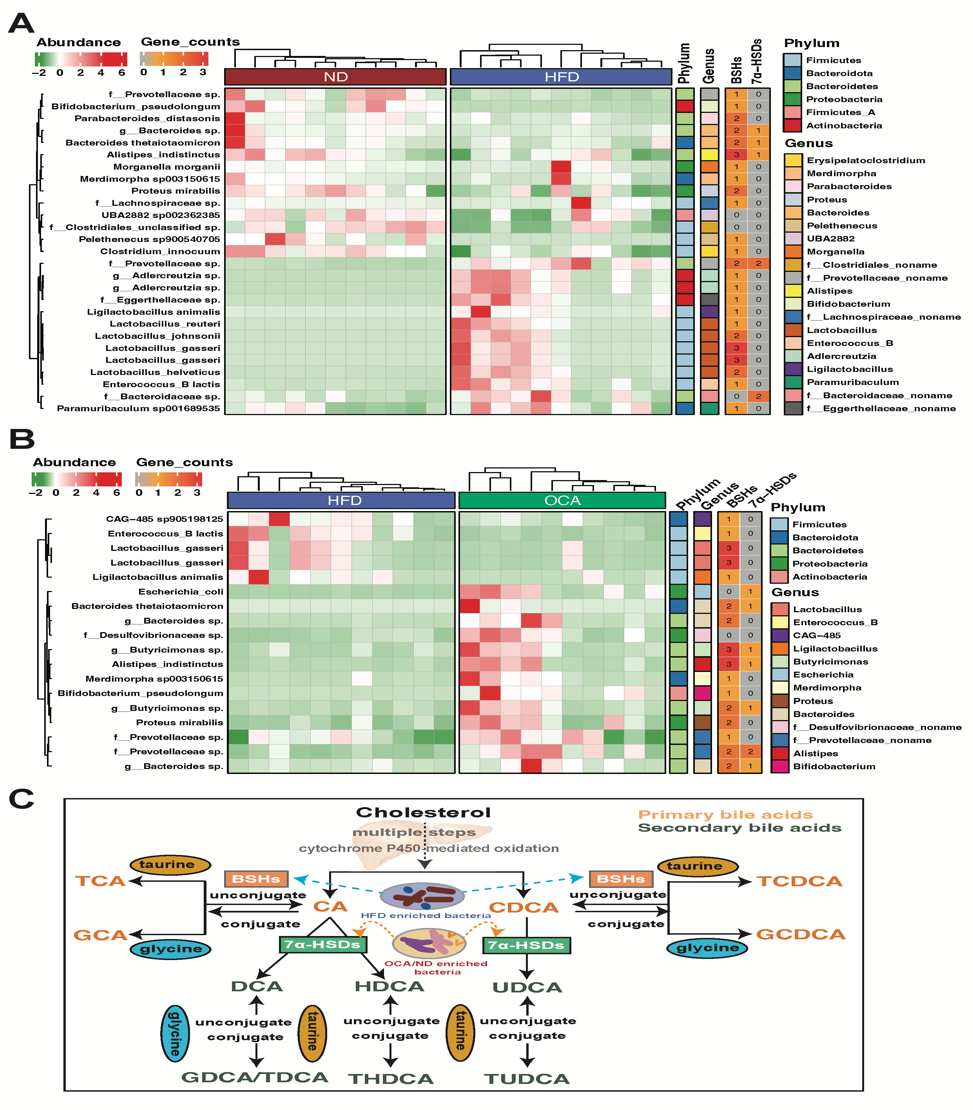
图2 差异肠道微生物编码胆汁酸转化酶热图及微生物影响宿主胆汁酸组成示意图
本研究初步揭示了肠道微生物通过调控胆汁酸代谢影响OCA对于NAFLD治疗作用的部分机制,为OCA用于NAFLD治疗提供了理论基础。关于各类胆汁酸如何影响宿主的生理代谢和疾病的发生发展,以及微生物与宿主之间相互作用如何影响宿主的健康仍需要后续更加深入的研究。
刘建军(云南大学、昆明医科大学)、孙嘉逸(北京医院)、博士后於江坤(云南大学,共同通讯作者)、硕士生陈杭(昆明医科大学第一附属医院)为论文的共同第一作者,张志刚研究员(云南大学)、马岚青(昆明医科大学第一附属医院)、于雪(北京医院)为论文的共同通讯作者。上述系列工作得到了云南省科技重大专项(202001BB050001)、第二次青藏高原综合科学考察研究项目(2019QZKK0503)、国家自然科学基金项目(U200220682060018, 81700438, 31970571, 81760108, 82160117)、云南省基础研究计划项目(202101AS070043)、国家重点研发计划(2018YFC2000500)、云南省应用基础研究项目(2018FE001(-027), 202001AY070001-129)的经费支持。
原文链接:https://doi.org/10.1038/s41522-023-00399-z
供稿:重点实验室
编辑:李哲
责任编辑:陈涛