近日,云南大学药学院、自然资源药物化学教育部重点实验室羊晓东教授/张洪彬教授团队在国际化学领域权威期刊《美国化学会志》上发表了题为“Nickel-Catalyzed Regio- and Enantioselective Hydroalkenylation of Aldehydes with 2‑Azadienes”的研究论文(J. Am. Chem. Soc. 2025, 147, 30190)。团队利用2-氮杂丁二烯独特的化学性质,首次实现了其对醛类化合物的不对称氢烯基化反应。该新型合成策略能够高效、高对映选择性地构建含亚胺基团的手性仲烯丙醇类化合物,并进一步通过氢化及官能团转化,合成了手性γ-氨基醇及其衍生物,为该类生物活性分子和天然产物的合成提供了一种新途径。

羰基化合物的开发与利用长期以来备受化学界关注,原因在于羰基加成产物(手性醇)广泛存在于天然产物、药物分子及功能材料中。其中,醛的不对称加成所得到的手性仲烯丙醇,是一类重要的手性砌块,其羟基与烯基部分易于进行多样化修饰,从而引导复杂分子的高效构建。迄今,由醛为起始原料,经过催化不对称合成手段获得手性仲烯丙醇的研究已取得了一系列进展。代表性策略包括:烯基金属试剂(或卤化物)与醛的不对称加成反应(图1a);催化不对称炔烃与醛还原交叉偶联反应(图1b)。由于以上合成方法中烯烃试剂需经过预金属化处理,导致其普遍存在底物适用范围有限和反应原子经济性差等问题。因此,醛与烯烃的直接氢烯基化反应作为一种高效且原子经济性优异的策略,并已在部分研究中取得进展。例如,利用过渡金属镍/Lewis酸或Brønsted酸协同催化体系实现了醛的直接烯基化反应(图1c)。然而,该类反应的不对称催化研究尚未实现,尤其是针对含氨基官能团取代手性仲烯丙醇的合成,仍面临显著挑战。
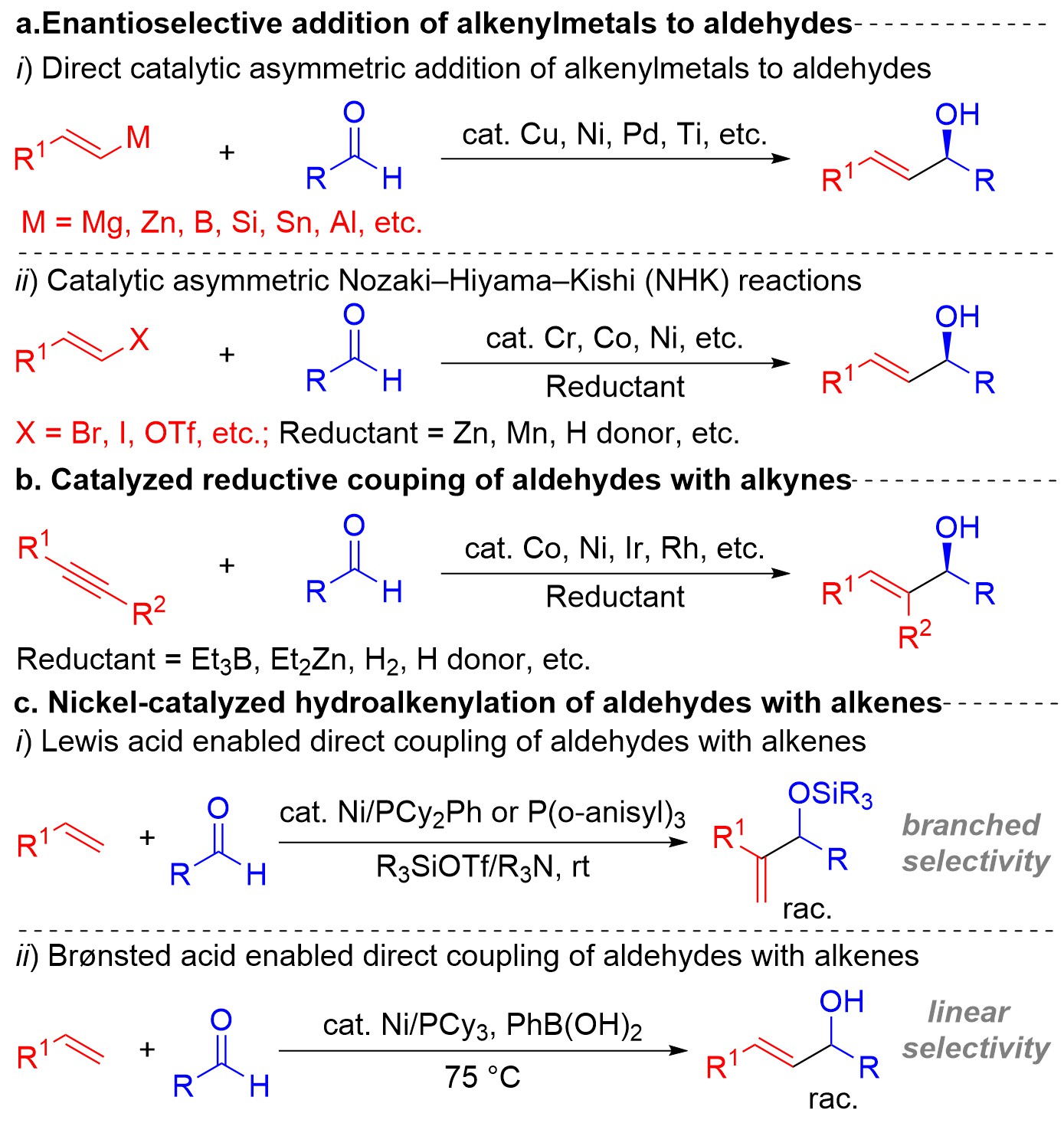
图1.烯丙基醇及其衍生物的合成方法
鉴于γ-氨基醇在药物化学、天然产物合成及有机合成化学中的重要性,羊晓东教授/张洪彬教授团队基于前期研究基础(J. Am. Chem. Soc. 2024, 146, 30947;J. Am. Chem. Soc. 2023, 145, 16045; Angew. Chem. Int. Ed. 2023, 62, e202300605),发展了一种过渡金属镍催化的醛与2-氮杂丁二烯的不对称氢烯基化反应,高效、高对映选择性地合成一系列手性γ-氨基醇前体化合物。该方法以2-氮杂丁二烯作为烯基试剂,以100%原子经济性和绝对的立体反式(E)选择性合成了多类型手性γ-氨基仲烯丙醇化合物,产率高达96%,ee值高达99%。同时,该方法具有广泛的底物适用性,包括脂肪醛/芳香醛/杂环醛/大位阻醛以及烷基或芳基取代的2-氮杂丁二烯,特别是实现了(S)-布洛芬、吉非罗齐、(S)-萘普生等药物分子的手性烯丙醇官能团修饰,展现出在药物化学领域的良好应用潜力。此外,克级规模反应的顺利实施进一步验证了该策略具有良好的可扩展性(图2a)。产物亚胺取代的手性仲烯丙醇衍生物经氢化还原,可一步实现亚胺保护基脱除及碳碳双键还原,从而获得对映体富集的γ-氨基醇(图2b)。通过对γ-氨基官能团进行精准结构修饰,成功构建了一系列重要的杂环合成前体(图2c)。进一步利用氨基醇的双官能团特性,经分子内Mitsunobu环化及亲核取代反应等,可获得氮杂环丁烷、噁唑啉、环磺酰胺内酯和环氨基甲酸酯等手性分子砌块(图2c)。总之,基于该合成新策略所获得的γ-氨基醇衍生物作为一种关键手性多功能中间体,可成功实现多种杂环骨架的高效转化,充分展示了该合成策略在构建杂环化合物中的实用价值和应用潜力。
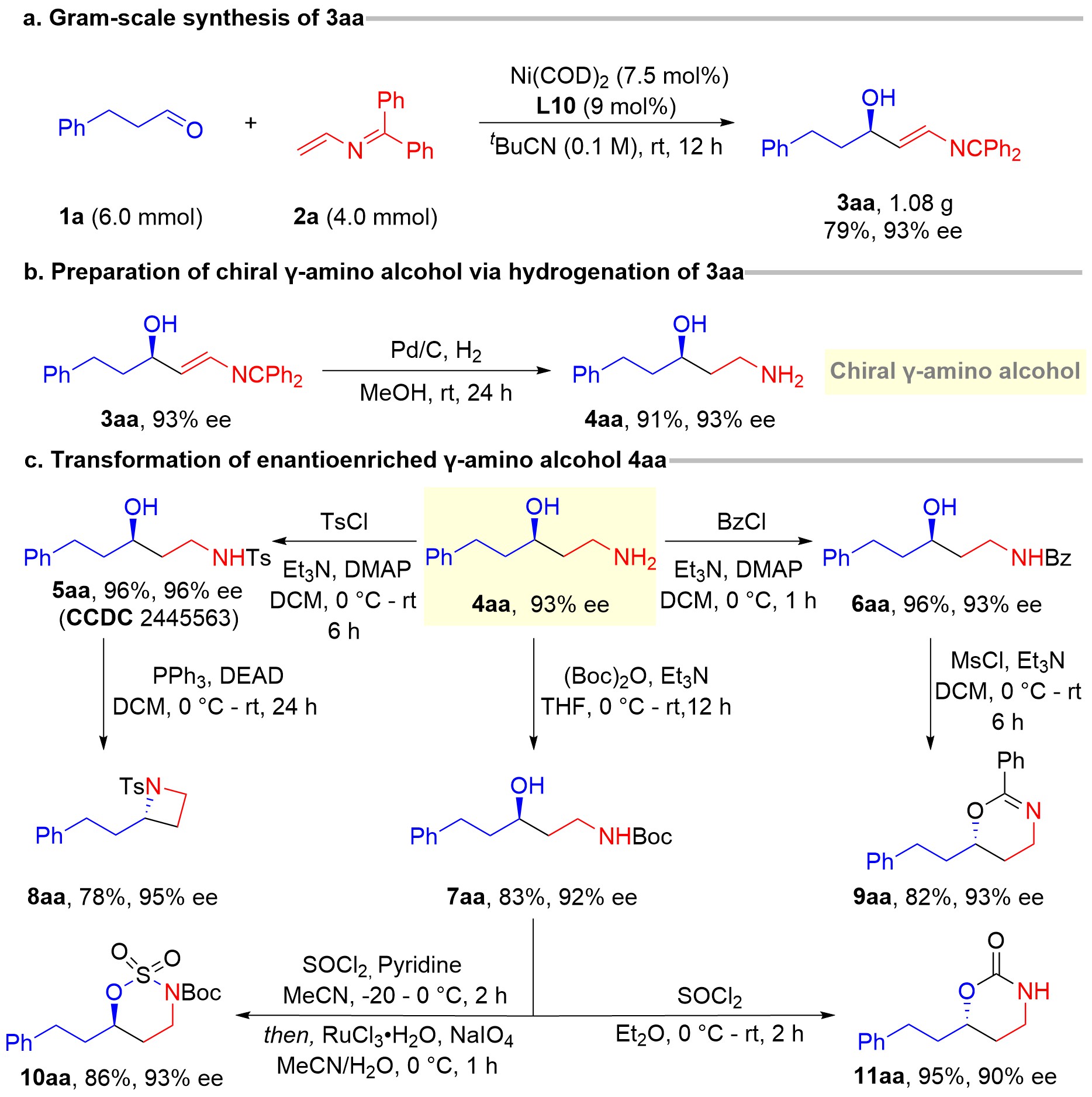
图2.镍催化不对称氢化氨化反应底物拓展与产物衍生化研究
云南大学羊晓东教授、段胜祖副教授和宾夕法尼亚大学Patrick. J. Walsh教授为论文的共同通讯作者,云南大学为论文第一单位。博士生杜娅、张乐宁为共同第一作者,硕士生杨湘、刘思娜参与了部分研究工作。该项工作得到了国家自然科学基金、云南省基础研究计划以及云南省兴滇英才支持计划的资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.5c08602
来源:自然资源药物化学重点实验室
编辑:张懿淼 责任编辑:李哲